"C'est pas bon ça la nitroglycérine !" ?
Bien le bonjour à tous :)
Rien de mieux pour introduire le sujet qu'un bon vieux "Bip Bip et Coyotte"
youtube.com, chaîne Matthew Sanborn Smith
Vous l'aurez compris la nitroglycérine est à la fête. Dans ce billet nous allons étudier 6 films chimie à l'appui !
Films étudiés
- Atlantide l'empire perdu
- Il était une fois la révolution
- un extrait de la série Lost
- La légende de Zorro (et "nitroglycérine" de la série animé Lucky Luke)
Qu'est-ce que la nitroglycérine
C'est en 1846 que Sobrero découvre la nitroglycérine et, juste avant de mourir dans une explosion, ce dernier précisera dans son cahier de laboratoire : "NB : évitez les chocs !!!".
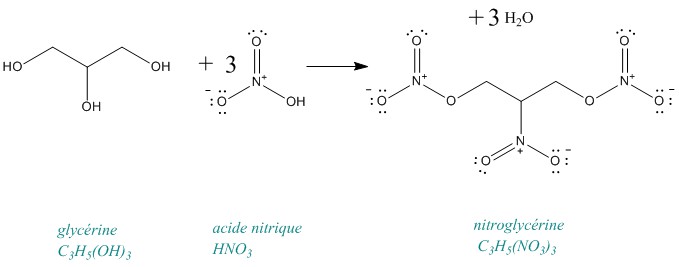
Non plus sérieusement, la nitroglycérine est synthétisée par la réaction entre la glycérine et l'acide nitrique. C'est un liquide huileux, incolore et explosif. Cette molécule est très instable, ainsi des chimistes mourront en tentant d'en synthétiser et, son transport est une entreprise plutôt risquée. Parmi les exemples célèbres on a notamment l'explosion de l'usine Nobel de Heleneborg en Suède, où mourût notamment le frère cadet d'Alfred Nobel.
Réaction de formation de la nitroglycérine :
Lien vers une vidéo de la BBC : explosion de nitroglycérine filmé en slow motion
Dans cette vidéo vous remarquerez les précautions de synthèse afin d'éviter tout échauffement durant la réaction :
- ajout goutte à goutte de l'acide dans la glycérine
- contrôle de la température dans le ballon
- attente de stabilisation de la température entre chaque ajout
- travail sous la hotte derrière la vitre qui reste baissée lors des ajouts
En effet la réaction est très exothermique : cela signifie qu'elle dégage beaucoup de chaleur, ce qui est problématique puisque pour le produit synthétisé une élévation de température provoque une explosion.
Vous noterez tout de même la présence d'une agitation à l'aide d'un barreau aimantée...ceci sera discuté par la suite ;)
Atlantide l'empire perdu : peut-on boire de la nitroglycérine ?
"Petit ne me dis pas que tu as bu ça ! C'est pas bon ça la nitroglycérine !" : petite citation de mon personnage préféré du film : Enzo, le respo explosions de l'expédition. Mais ce que dis Enzo est-il juste ? Peut-on boire de la nitroglycérine ? Étudions ce Disney chimie à l'appui !
L'extrait est à 0:55
youtube.com, chaîne : Gaideness
La nitroglycérine a été découverte à une époque où certains chimistes goûtaient encore leurs produits, il est bien évident qu'actuellement cette pratique est révolue. Ainsi en 1846 Sobrero déposa effectivement une goutte d'une solution diluée de nitroglycérine sur sa langue. Ce dernier ressentit presque immédiatement un mal de tête violent persistant pendant plusieurs heures.
Et comme les chimistes sont complètement fous et bien deux autres retentèrent l'expérience quelques années plus tard : A.G. Fields en 1858 et William Murrel vers 1879. Le premier décrit : une impression de plénitude, des nausées qui surviennent après une demi-heure de "sensation de faiblesse générale, presque un état syncopal". Murrel quand à lui, goutta une solution à 1% de nitroglycérine juste avant d'effectuer une consultation en tant que médecin, cette dernière fut très compliqué pour lui.[1]
Cependant si ces deux chimistes ont goûté la nitroglycérine ce n'est pas par juste folie, cette dernière est en effet à même de soigner une maladie très douloureuse : l'angine de poitrine ou angor. L'angor est une maladie causée par un manque d'apport en oxygène au cœur, la maladie provoque en effet le rétrécissement des artères coronaires et donc du débit sanguin. Or Murrel découvre que la nitroglycérine engendre une dilatation des artères et permet donc de mettre fin aux crises que subissent les malades. Le médicament est commercialisé encore aujourd'hui mais sous un nom sûrement plus vendeur : la trinitrine (composée de trinitrate de glycérol autre nom de la nitroglycérine).
La trinitrine (environ 18 mg de nitroglycérine)
posomed.fr
Pour conclure on peut effectivement boire de la nitroglycérine, ou plutôt une solution diluée de nitroglycérine. Cependant selon la concentration de la solution les effets seront différents pouvant aller des soins de l'angor à des douleurs crâniennes intenses, voire même pour de la nitroglycérine pure à la mort (mortel par ingestion).
Certaines questions vous taraudent peut être : la nitroglycérine même diluée peut-elle exploser ? Pourquoi n'explose-t-elle pas dans le corps ?
Ces questions seront traitées dans la seconde partie de ce billet à l'aide des 5 films restant sur des explosions de nitroglycérine :).
Lien ci-dessous très bientôt !
Références
- [1] Quand la médecine gagne, Pr P. Berche et Pr J-J. Lefrère
- wikipédia
Autres articles
Let the sky fall !
Bien le bonjour à tous, voici le tout premier article de la catégorie Chimagination. Si vous voulez découvrir ce que cette catégorie vous réserve n'hésitez pas à aller voir le descriptif sur la page facebook les petits béchers et le trailer sur YouTube . Bonne lecture :)
Allociné.fr
Rien de mieux pour passer le temps dans le train que de se mater un bon James Bond, et quel plaisir de pouvoir lancer son week-end au son de "let the Skyfaaaal ! When it crumbleeeeees !"...
Le film se déroule bien, le rythme est intense, quand soudain je tousse, je m'étouffe, je suffoque ! Aurais-je croqué malencontreusement la petite capsule de cyanure cachée sous ma fausse dent ? Que nenni ! Étudions ce film, chimie à l'appui :)
L'extrait et ses caractéristiques (attention spoiler)
La scène débute par les retrouvailles entre M et un ancien agent du MI6 : Tiago Rodriguez alias Silva. Ce dernier est dévoré par la rage envers M et le MI6 qui l'ont abandonné, lors d'une mission, aux mains des autorités chinoises. Ce dernier se fait alors torturer et, pour de ne pas parler, il décide de mettre fin à ses jours en croquant une capsule de "cyanure d'hydrogène" cachée sous une fausse dent. Cependant le composé ne le tue apparemment pas et lui ronge le visage ainsi que l'estomac.
Un poison célèbre
Le cyanure d'hydrogène est un poison célèbre, il est utilisé dans bon nombre de fiction sur l'espionnage ainsi que dans de nombreux thrillers. Il est très présent dans James Bond (James Bond contre Dr. No, l'espion qui m'aimait), mais aussi dans les romans d'Agatha Christie (meurtre au champagne et dix petits nègre). De nombreuses personnalités sont mortes en ingurgitant du cyanure : Alan Turing, Raspoutine, ainsi que certains dirigeants Nazi à la fin de la seconde guerre mondiale.
Il est également considéré comme arme chimique. Pendant la seconde guerre mondiale les allemands dégazait HCN à partir de zyklon B dans les chambres à gaz.
Les symptômes d'une intoxication au cyanure sont variables en fonction de la dose. On peut observer : apnée, coma, convulsion, vertige, gêne respiratoire, arrêt cardio-vasculaire, mort.
Mode d'action
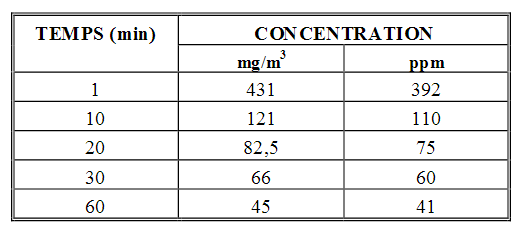
Le cyanure peut être présent sous plusieurs formes. Sous forme gazeuse : HCN il est létal en quelques minutes pour des concentrations dans l'air de 300 ppm. Sachant que pour HCN à pression et température ambiante 1ppm correspond à 1,10 mg/m3, la dose létale serait d'environ 330 mg/m3 [1]. Il est caractérisé par une légère odeur d'amande amère.
Seuils d'effet létaux de HCN
INERIS.fr
1ppm : 1 molécule de HCN pour 1 million de molécules d'air
Le cyanure peut aussi être présent sous forme aqueuse : HCN en solution, en effet comme ce dernier est soluble dans l'eau, on utilise donc les sels KCN et NaCN pour le dissoudre en solution en milieu acide (pour protonner l'ion CN-en HCN). Pour ces deux derniers il suffit de 100 à 300 mg en solution pour vous tuer en 5 min.
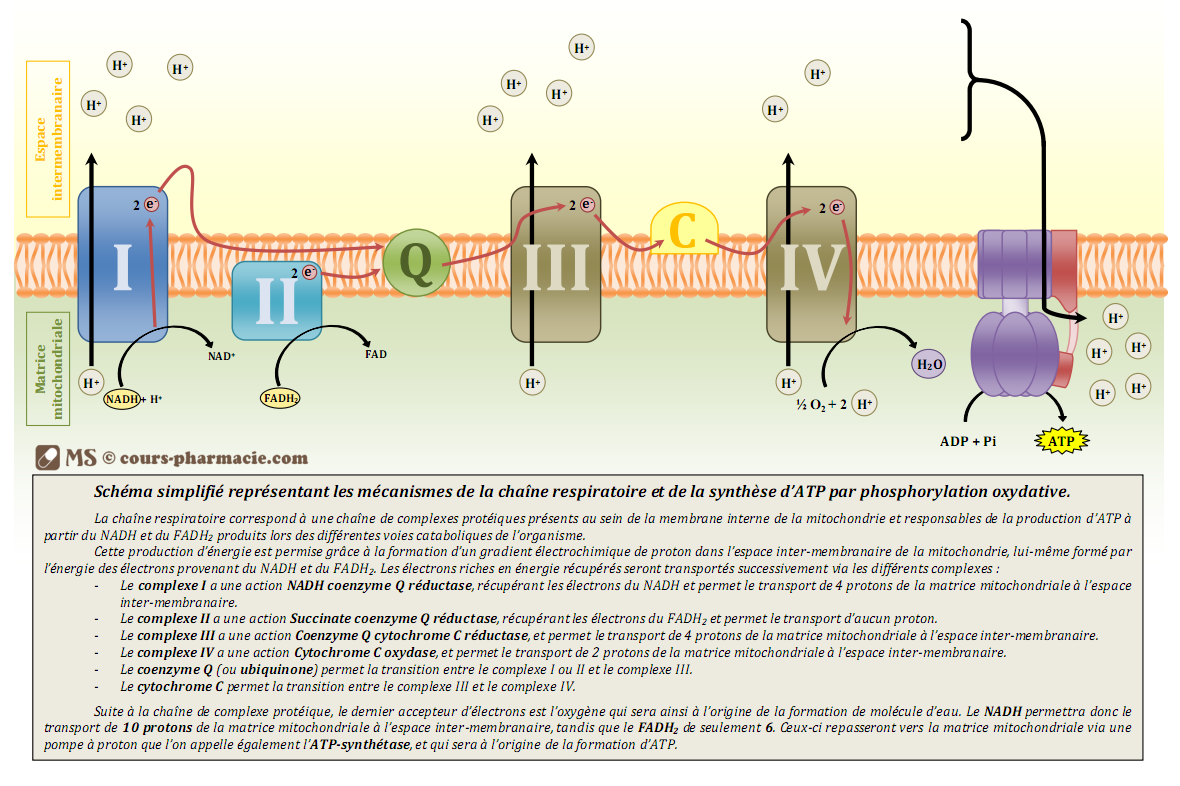
L'acide cyanhydrique conduit à la mort par inhibition d'une enzyme capitale pour le processus de respiration cellulaire : le cytochrome c oxydase. Dans chaque cellule humaine, la chaîne de respiration mitochondriale situés dans la membrane interne de la mitochondrie est constituée de 4 complexes (protéines). Ces 4 complexes ont pour rôle de produire un gradient de proton (augmentation de la concentration) entre la matrice mitochondriale (intérieur de la cellule) et l'espace inter-membranaire. Ce gradient est créé par une suite de réaction d'oxydation réalisée au niveau de ces quatre complexes.
Chaîne de respiration mitochondriale
cours-pharmacie.com
Le cytochrome c oxydase (complexe IV) est une enzyme qui catalyse la réaction entre le cytochrome c et O2, cette réaction consiste à réduire O2 en eau par 4 électrons. C'est la quatrième réaction le long de la chaîne respiratoire mitochondriale.
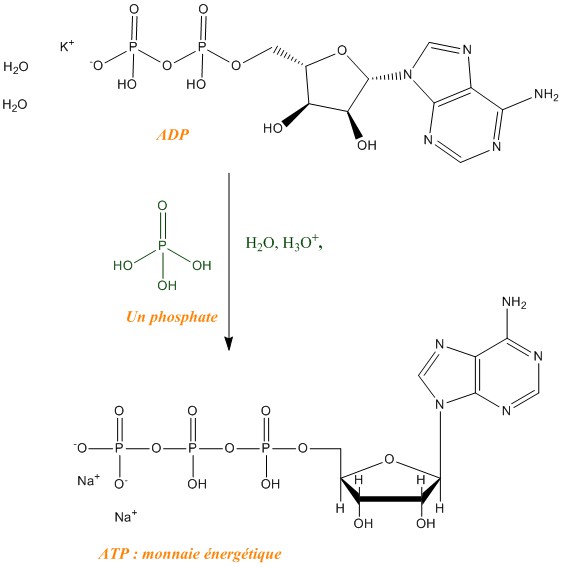
L'ensemble des quatre réactions est nécessaire pour la phosphorylation de l'ADP en ATP. L'inhibition d'une de ces réactions entraîne l'inhibition de toute la chaîne de respiration et donc de la production d'ATP. Or l'ATP est la "monnaie énergétique de l'organisme", ainsi sans cette dernière la cellule manque d'énergie pour son bon fonctionnement. Ceci explique donc la haute toxicité de HCN.
Les tissus riches en cytochrome c oxydase sont donc les plus touchés : notamment le cerveau et la rétine, provoquant alors l'anoxie : impossibilité pour les cellules d'utiliser l'oxygène, puisque la chaîne de respiration mitochondriale ne fonctionne plus.
Phosphorylation de L'ADP en ATP
Les soucis dans Skyfall
Dans Skyfall le film précise que le poison employé est le cyanure d'hydrogène HCN, ce dernier devait probablement être présent sous forme solide (NaCN et KCN) dans la capsule et lorsque ce dernier croque la capsule, il libère des ions CN- en solution. Puis l'acidité des sucs gastriques présents dans l'estomac permet ensuite de former HCN à partir de CN-(aq).
Silva nous indique que le poison ne l'a pas tué mais lui a complètement fait fondre la face. Cela n'est pas possible, à moins que la dose présente dans la capsule soit très inférieure à 100mg, le poison aurait dû véritablement le tuer au bout de 2-3 minutes. Maintenant concernant l'aspect corrosif de HCN, ce dernier ne corrode pas la peau ou les os.
L'analogie qui a dû être faite par les réalisateurs est que ce dernier est un acide : l'acide cyanhydrique. En effet certains acides peuvent se montrer très corrosif pour les os comme par exemple l'acide fluorhydrique (HF), utilisé notamment dans la série "Breaking Bad" pour dissoudre un cadavre [2]. Cependant la dénomination acide ne veut pas forcément dire que le composé corrode, mais juste que HCN est susceptible de perdre un proton H+ pour former CN-.
En fait HCN est un acide faible : pka = 9,2 environ, c'est donc un acide plus faible que l'acide citrique présent dans les citrons et l'acide éthanoïque (CH3COOH) constituant le vinaigre. Ces derniers ne font évidemment pas fondre le visage, HCN n'ont plus.
Fiche toxicologique de HCN [1]
Vidéos Breaking Bad avec l'acide fluorhydrique [2]
Voilà j'espère que cet article vous a plu, si vous avez des questions, des remarques n'hésitez pas à les poser dans les commentaires : sur facebook où directement sur le blog :). Et si vous le désirez, vous pouvez m'encourager à continuer de publier en likant ou en partageant cet article :)
Références
- http://www.wired.com/2013/04/oh-those-movie-spies-and-their-cyanide-pills/
- pages wikipédia sur : intoxication au cyanure, HCN, NaCN, KCN
- Inrs
Autres articles
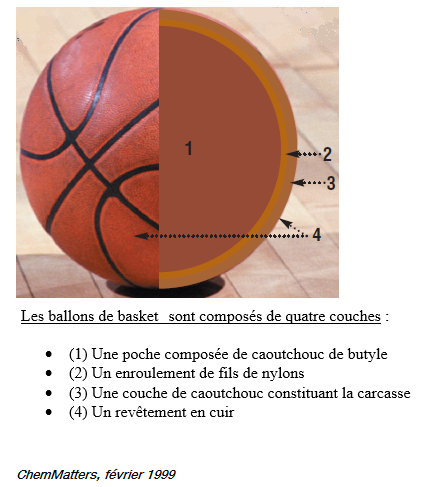
La chimie du ballon de basket (2)
Voilà la suite de la composition de notre ballon préféré :)
Voici le lien de la première partie pour d’éventuels rappels
2. La deuxième couche
Une fois que l'on a obtenu la première couche constituée de butyle caoutchouc, on passe logiquement à la deuxième couche.
Rappel de l'allure de la première couche :
alibaba.com
On entoure maintenant notre poche sphérique de fils de nylon ou de polyesters. Ce sont de solides ficelles qui vont permettre de maintenir la forme du ballon de basket, et notamment d'éviter la formation de bosses. Les ballons de grandes qualités peuvent avoir plus de 3000 m de fils. Le polyester est certes moins couteux pour les fabricants mais aussi moins résistant que le nylon : il donnera des ballons moins durables.
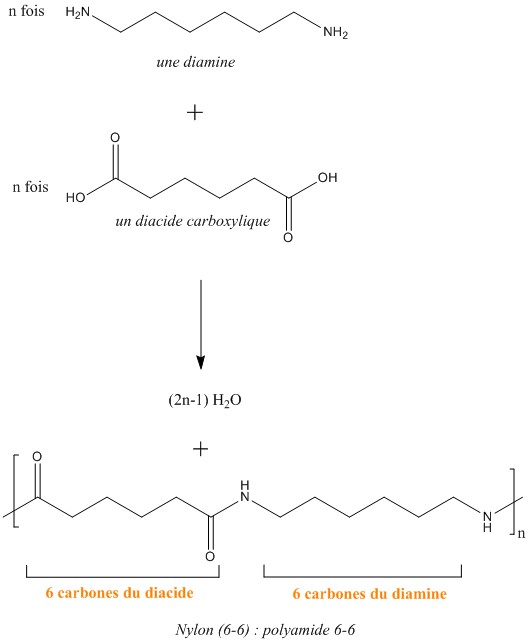
Synthèse du nylon :
Le nylon est un copolymère d'un diacide carboxylique et d'une diamine, on forme alors un polyamide. C'est une réaction de polymérisation par étape : cela signifie que les monomères réagissent entre eux pour former des dimères, puis des trimères, et ainsi de suites jusqu'au polymère. Plus précisément on est en présence ici de polycondensation (élimination d'une molécule d'eau à chaque étape).
Ci-dessus est représentée la synthèse du nylon 6-6, mais il en existe d'autres types tels que le 4-6 ou 2-6 (le premier chiffre indique le nombre de carbone du diamine). Le nylon a été grandement exploité par l'industrie textile notamment par la création des bas et des collants, il est aussi beaucoup utilisé pour les articles de sport et les objets moulés, et également pour les fils de pêches. Ces exploitations sont grandement liées à son ultra-résistance, par exemple pour un fil de pêche monofilament la force de rupture est de plus de 100kg.
Vielle pub pour des bas en nylon :
lesechos.fr
Fil de nylon de 0.8 mm :
alittlemercerie.com
Sur internet vous pourrez facilement trouver des vidéos de synthèse du nylon, en voici deux :
Revenons à notre ballon de basket, on avait la possibilité d'utiliser du nylon ou du polyester. Le polyester est aussi un polymère composé de la répétition d'une fonction ester. La réaction est très analogue à celle du nylon et s'effectue cette fois entre un diacide carboxylique et un diol (molécule avec deux fonctions alcools).
Troisième couche du ballon
La troisième couche recouvrant les deux autres est constituée de caoutchouc (naturel, composite ou butyle caoutchouc). Cette étape se réalise dans un moule afin de faire apparaître les reliefs extérieurs sur le ballon (sillons, logos..). La couleur et les autocollants sont ajoutés dans le moule juste avant la vulcanisation du caoutchouc. Les ballons de hautes qualités possèdent même un revêtement en cuir par-dessus.
Références
- Article ChemMatter, février 1999, "The chemistry of basketball"
- Wikipédia