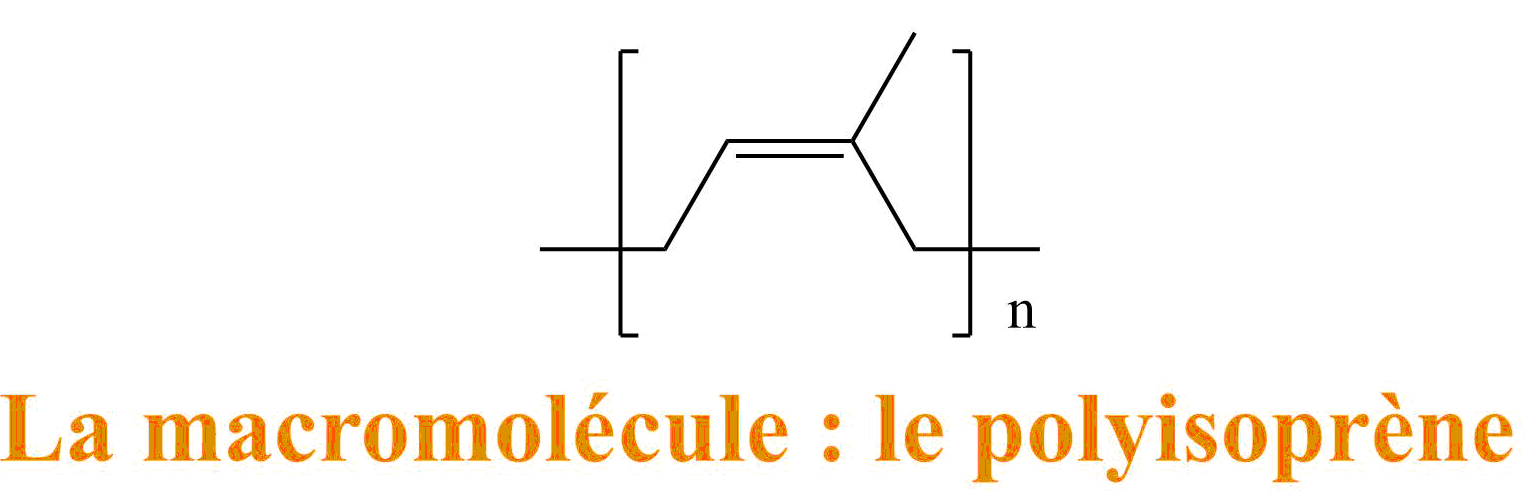Chimagination
Incroyable ! On dirait de la magie !
Harry Potter et la chambre des secrets
Bien le bonjour à tous :)
Nous voici en route pour une nouvelle année à Poudlard, avec son lot d'elfes de maison, de gâteau renversé sur la tête, de voiture volante, de saule cogneur et autre basilic : bref une scolarité tout à fait classique...Dumbledore président ! ;)
- Aujourd'hui nous allons rempoter des mandragores, qui peut me dire quelles sont les propriétés de la mandragore ?
- La mandragore, ou mandragora est utilisée pour ramener ceux qui ont été pétrifiés à leur état d'origine. Elle est aussi très dangereuse, le cri de la mandragore est mortel pour quiconque l'entend !
Merci miss Granger, mais quand est-il d'un point de vue chimique ? ;)
Les mandragores existent
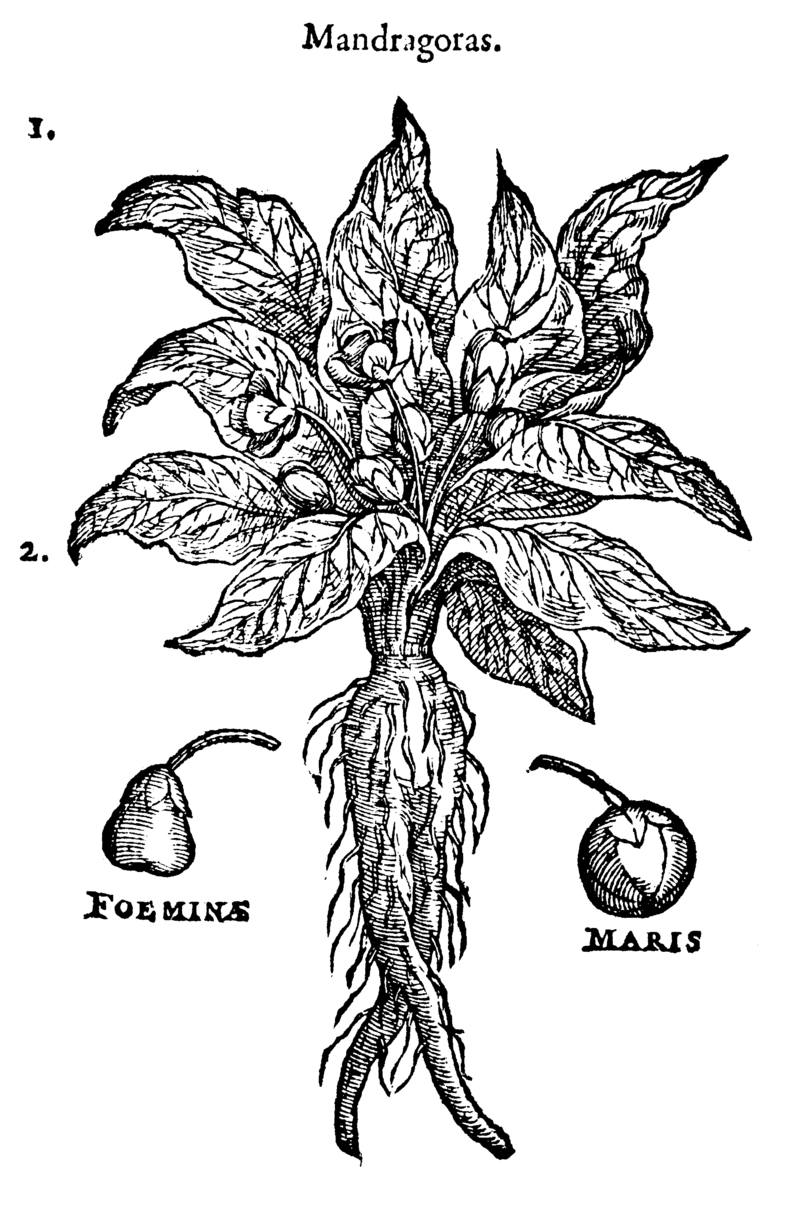
La mandragore est une plante qui existe bel et bien, son nom botanique est Mandragora officinarum. Ces racines ont un aspect humanoïde qui est à l'origine de nombreux mythes, c'est d'ailleurs l'un d'entre eux qui est repris dans Harry Potter : elle émet un cri mortel lorsqu'on la déracine.
La mandragore :
wikipédia
Cette plante est constituée de nombreux alcaloïdes, ce sont des molécules organiques cyclique contenant un atome d'azote dans leur cycle. Elles sont très souvent d'origine naturelle et ont des propriétés pharmacologiques à faible dose.
La caféine, la morphine, la nicotine, et la strychnine sont des alcaloïdes (la terminaison en "ine" est caractéristique).
A forte dose certains alcaloïdes peuvent être mortels. Ainsi même si la mandragore a un effet anesthésique (supprime la sensibilité du système nerveux) qui aurait pu être exploitable, son utilisation fut très limitée par un nombre important d'effet secondaire (présence de trop d'alcaloïdes).
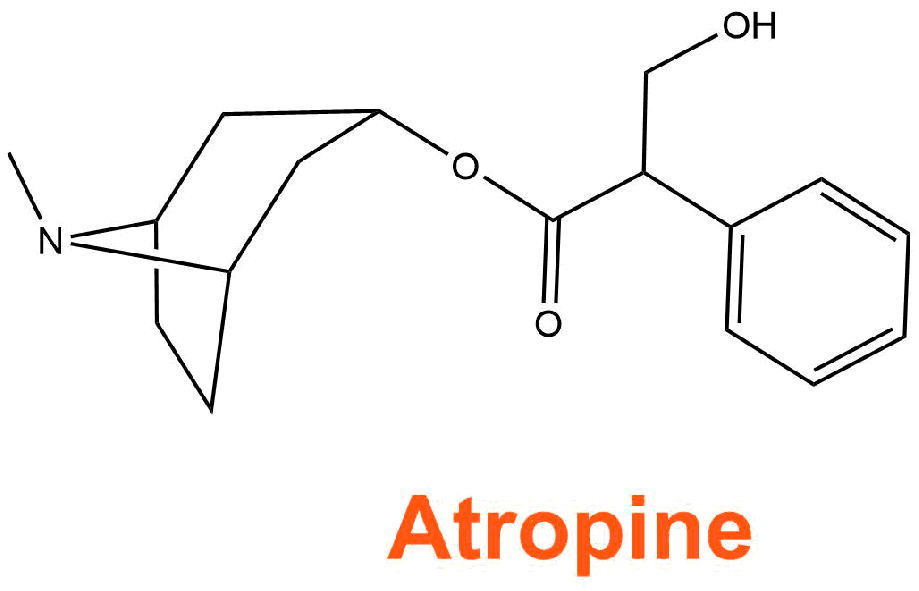
L'astuce du chimiste est alors d'isoler la molécule présente dans les racines de mandragores et responsable de l'effet thérapeutique. Ainsi c'est en 1885 que le chimiste français Crouzel réussi à isoler la mandragorine ou encore appelée l'atropine.
Pas si loin...;)
Dans Harry Potter la mandragore sert à ramener à la vie les personnes pétrifiées par le terrible basilic, nous allons voir que les effets de l'atropine n'en sont pas si loin ;)
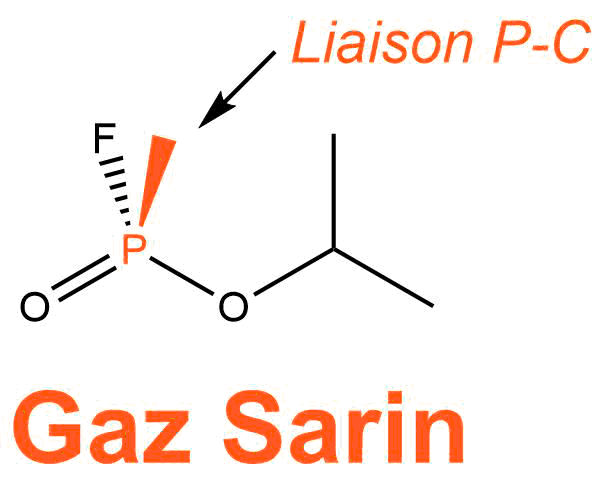
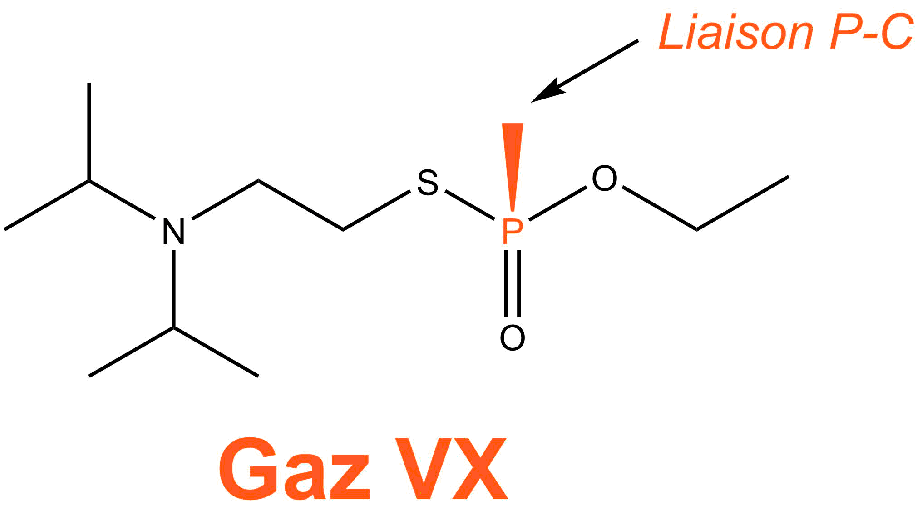
L'atropine est utilisée comme antidote des gaz de combat neurotoxiques comme par exemple le gaz VX ou le gaz sarin. Ces gaz ont la particularité d'être tous des composés organophosphorés : ils possèdent une liaison phosphore-carbone.
Ces gaz de combats sont hautement toxiques pour l'organisme car ils provoquent une stimulation trop importante des cellules nerveuses du système parasympathique : celui qui contrôle le fonctionnement autonome des organes, des glandes et des vaisseaux sanguins.
Cette sur-stimulation mène à la contraction des pupilles, une salivation importante, des urinations involontaires, des convulsions et à une mort par asphyxie causée par l'arrêt des muscles respiratoires.
Film the rock, 1996, Dr. Stanley Goodspeed joué par Nicolas cage, tentant de récupérer les capsules contenant le VX
Pour comprendre le rôle de l'atropine en tant qu'antidote, il faut tout d'abord étudier l'action des composés organophosphorés :
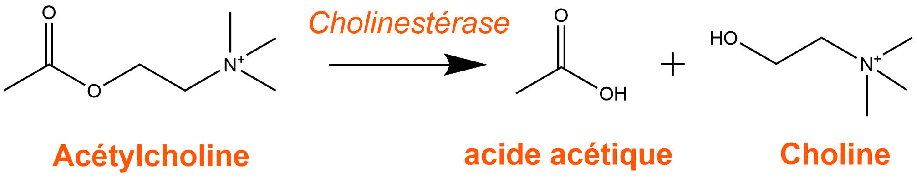
Ces gaz provoquent dans le corps humain une inhibition de la cholinestérase : une enzyme responsable de l'hydrolyse (la destruction) de l'acétylcholine en choline. C'est une réaction d'hydrolyse d'un ester (acétycholine) en un acide carboxilique (acide acétique) et un alcool (choline).
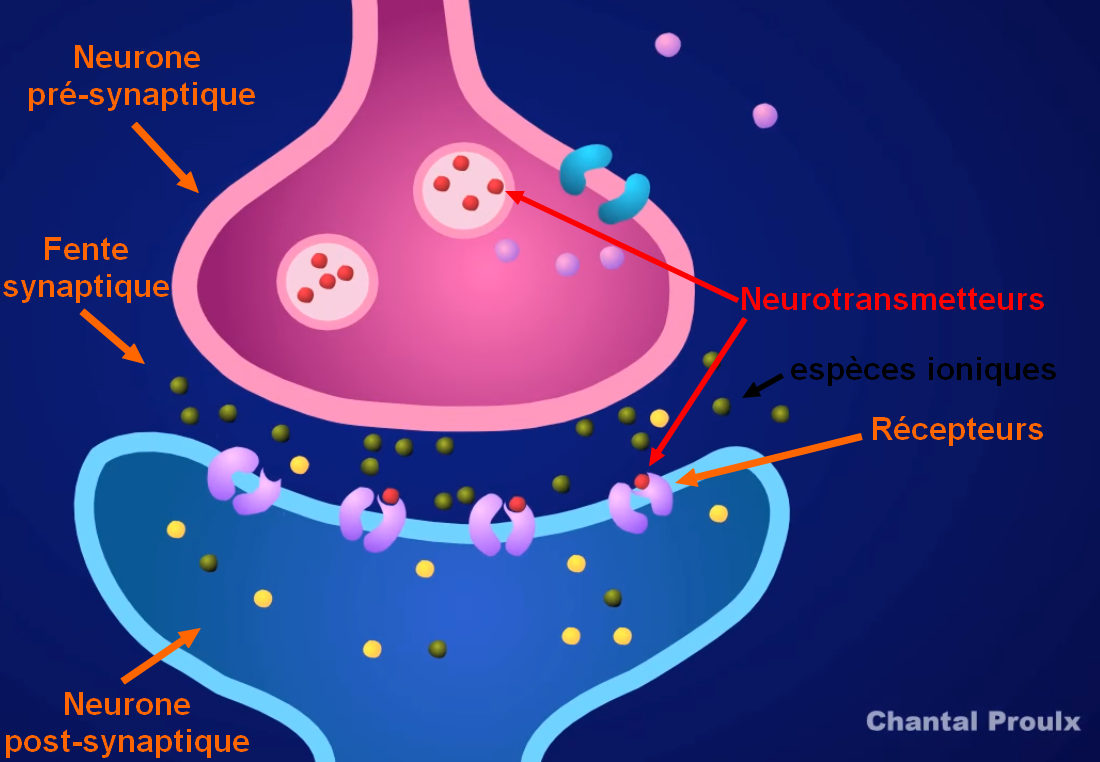
Or l'acétylcholine est un neurotransmetteur (messager chimique entre deux neurones), elle se fixe sur les récepteurs du neurone post-synaptique et provoque la propagation du message nerveux entre les neurones, pour conduire à terme à la contraction/activation des muscles.
La contraction est stoppée par la destruction du neurotransmetteur par la cholinestérase.
https://youtu.be/nM_v114rjwo, Chantal Proulx
Ainsi l'inhibition de la cholinestérase par les composés organophosphorés conduit à une présence permanente de l'acétylcholine sur le récepteur et donc à une contraction permanente des muscles, pouvant aller jusqu'à l'asphyxie.
L'atropine : l'arme ultime contre le basilic
L'atropine agit en se fixant sur les récepteurs post-synaptiques à la place de l'acétylcholine, ainsi l'abondance d'acétylcholine n'a aucun effet puisque ces dernières n'ont pas accès aux récepteurs.
De plus même si l'atropine est fixée aux récepteurs, elle est inerte et ne provoque pas d'influx nerveux : les muscles du système parasympathique se relâchent donc par absence de signal.
L'atropine permet donc d'éviter l'activation permanente des muscles du système parasympathique : ceux qui fonctionnent de façon autonome. Et donc d'empêcher une sorte de paralysie, mais qui ne concernerait pas les muscles du système somatique (les muscles que l'on fait fonctionner volontairement, notamment pour se mouvoir).
Prendre de l'atropine après un fougueux mais téméraire eye contact avec notre ami le basilic ne vous rendra donc pas vos mouvements, mais cela vous permettra de rester en vie, du moins temporairement ;)
Bibliographie
- World of chemistry : Essentials , fourth editionPar Melvin D. Joesten,John L. Hogg,Mary E. Castellion
- Wikipédia : pages mandragore, organophosphorés, atropine
- http://www.popularmechanics.com/science/health/a9388/how-it-works-atropine-the-nerve-gas-antidote-15859092/
Autres articles
Roger Rabbit et la trempette The one ring
Tintin et le caoutchouc
Tintin au Congo (Ed. Casterman 1946)
Bien le bonjour à tous :)
Dans la bande dessinée Tintin au Congo, notre cher ami Tintin redouble d'ingéniosité pour nuire aux animaux d'Afrique.
Afin de se venger d'un buffle l'ayant projeté dans l'eau, Tintin utilise les propriétés de l'hévéa pour construire un lance pierre géant et assommer le pauvre animal. Analysons ce passage chimie à l'appui ;)
Voici le passage étudié :
Le caoutchouc
Comme nous l'avions vu dans l'article sur : La chimie du ballon de basket, le caoutchouc est un polymère. C'est à dire qu'il est constitué de molécules de très grande taille (et de très grande masse molaire) : des macromolécules.
Ces macromolécules sont caractérisées par la répétition de petites molécules : on parle d'unité de répétition. Ces petites molécules s'obtiennent après réaction d'une molécule de départ avec elle-même, cette molécule de départ c'est le monomère.
Dans le cas du caoutchouc naturel :
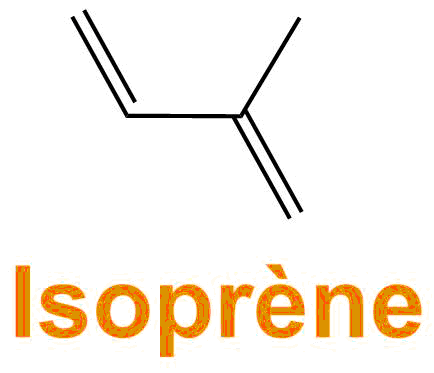
- La "molécule de départ" = monomère est l'isoprène
- La macromolécule : est une répétition d'une petite molécule provenant de l'isoprène de départ (après qu'il ait réagit)
Le polymère caoutchouc est donc constitué d'un nombre important de ces macromolécules : longue chaîne que l'on peut assimiler à des spaghettis, le polymère correspond alors à l'ensemble du plat de spaghetti.
Dans Tintin
Tintin extrait le caoutchouc de "l'arbre à caoutchouc", aussi appelé hévéa. La sève de cet arbre : le latex, est un liquide laiteux constitué de 70 % d'eau et de 30 % de caoutchouc.
Comme le précise très bien Tintin, le latex sortant de l'arbre doit ensuite être séché pour faire partir l'eau et ne conserver que le caoutchouc. Cependant Tintin a oublié de nous faire part d'une étape cruciale, celle qui donne son élasticité au caoutchouc : la vulcanisation !
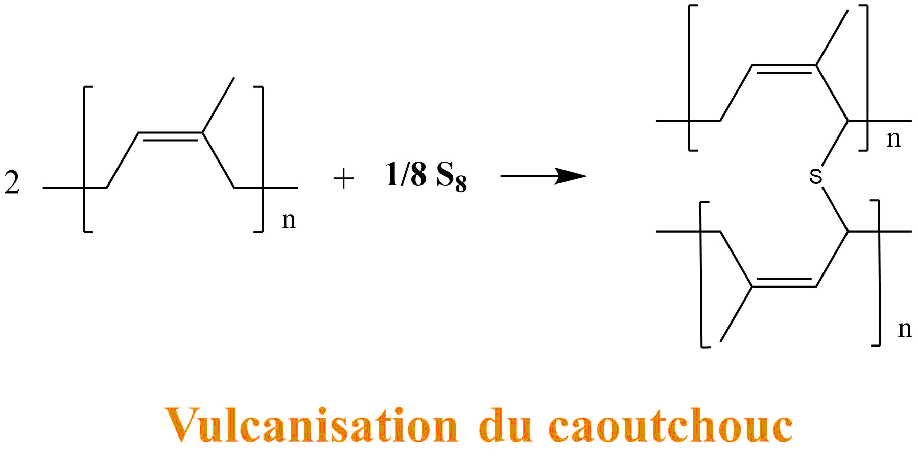
La vulcanisation est une réaction chimique qui consiste à relier chaque longue chaîne (formant une macromolécule) entre elles. Cela revient à relier tous les spaghettis entre eux.
Pour cela il faut ajouter un ingrédient indispensable : le soufre. Ce dernier va réagir avec les doubles liaisons présentes dans nos chaînes et former des ponts entre les chaînes.
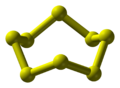
Le soufre, présenté dans la réaction ci-dessus, est sous sa forme solide la plus stable : appelé Sα ou encore S8.
Soufre S8, chaque boule correspond à un atome de soufre :
wikipédia
Les ponts ainsi formés agissent tels des ressorts sur notre polymère. Quand on l'étire le polymère se déforme puis, il revient dans son état initial lorsque la contrainte est stoppée.
La vulcanisation est une étape délicate, trop de soufre entre nos chaînes va rigidifier la structure et le composé ne sera plus élastique. De même trop peu de ponts va conduire à une faible élasticité.
Tintin ne peut donc pas utiliser directement le caoutchouc sortant de l'hévéa pour fabriquer son lance pierre.
Un grand merci à mon prof de Chimie de prépa qui nous a présenté le cours sur les polymères de manière ludique et attractive avec cet exemple :).
Bibliographie
- http://www.societechimiquedefrance.fr/caoutchouc.html
- https://fr.wikipedia.org/wiki/Vulcanisation
Autres articles
Gandalf le blanc
Gandalf le blanc, le retour du roi
- "Hahahaha ! Vous n'avez aucun pouvoir ici Gandalf le gris" (Théoden en mode vieux schnock)
- (petite musique sacrée "haaaaaaaâ !")
- Hahaa ! Et bim dans ta face Sarouman, mes vêtements sont d'une blancheur éclatante (Gandalf)
- "Oh non ce n'est pas possible ! Comment fait-il pour avoir des vêtements aussi blancs ?!" (Sarouman)
- Et bim ! Coup de bâton !
Là est toute la question, comment Gandalf fait-il pour passer de gris à blanc éclatant ? Dans le livre il est précisé que "il est renvoyé sur terre car sa tâche n'est pas finie", mais devant cette explication un peu oiseuse le chimiste ricane doucement et un mot lui vient en tête : azurants !
Juste le blanc ;)
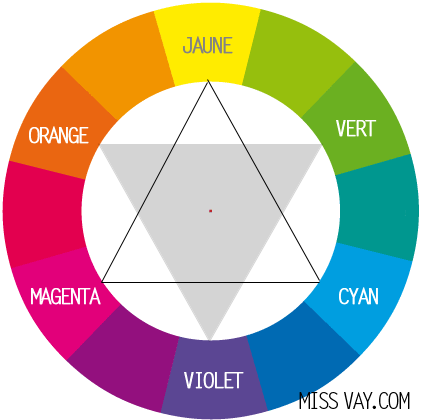
Tout d'abord précisons ce qu'est "le blanc" : c'est un mélange de toutes les couleurs. Lorsque la lumière arrive sur un objet, pour que ce dernier nous apparaisse blanc, il faut donc qu'il renvoie vers nos yeux toutes les longueurs d'ondes du spectre visible (donc toutes les couleurs).
Si un objet absorbe une couleur du spectre visible, il apparaît de la couleur complémentaire. Et s'il absorbe toutes les couleurs il est noir. On peut donc déterminer les couleurs qu'un objet absorbe grâce au cercle chromatique.
La couleur absorbée est à l'opposé de la couleur que l'on observe :
- Mais dis-moi Jamy, quel rapport avec notre cher ami Gandalf ?
- Et bien c'est très simple...
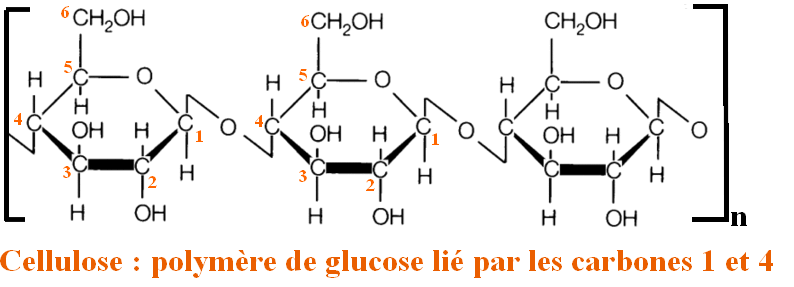
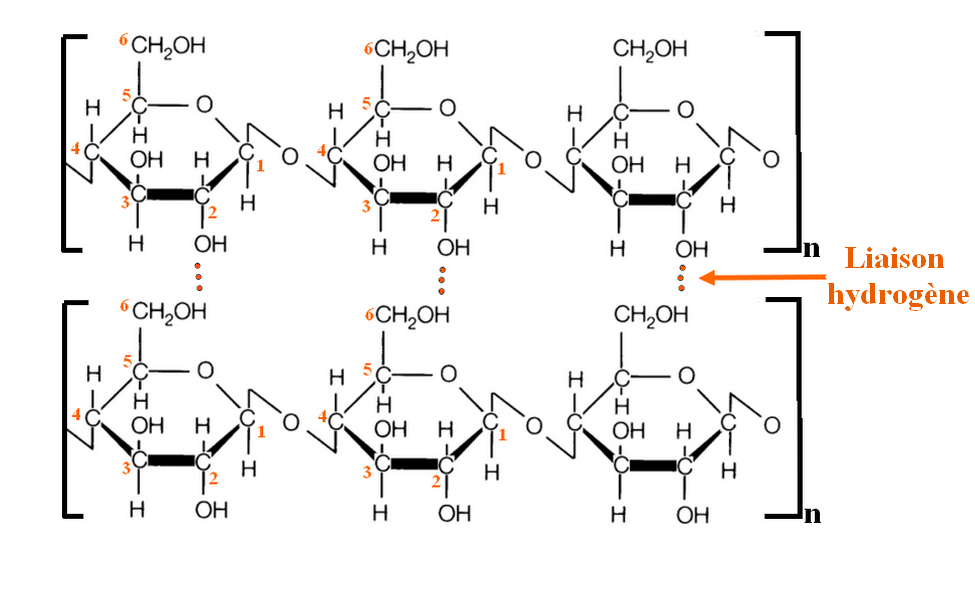
Le souci que devrait avoir notre ami Gandalf, c'est que ses vêtements sont faits de coton. Le coton est composé essentiellement de cellulose : un polymère (répétition d'un même motif chimique) de D-glucose.
Les fibres du coton proviennent donc de ces longues chaînes, liées entre elles par des liaisons hydrogènes (liaison électrostatique entre un hydrogène et un oxygène ici, un peu moins forte qu'une véritable liaison covalente).
Le principal souci du coton c'est qu'il absorbe dans le bleu, ainsi normalement tous nos habits faits de coton devraient nous apparaître jaunâtre (couleur complémentaire du violet-bleu).
Pour pallier à ce problème, notre ami Gandalf, vraiment en avance sur son temps à bien pris soin d'ajouter des azurants optiques à sa magnifique cape blanche.
Les azurants
Les azurants optiques sont des composés qu'on ajoute aux vêtements (environ 1% en masse), pour que ces derniers apparaissent blancs et non jaunâtres, voir même "plus blanc que blanc".
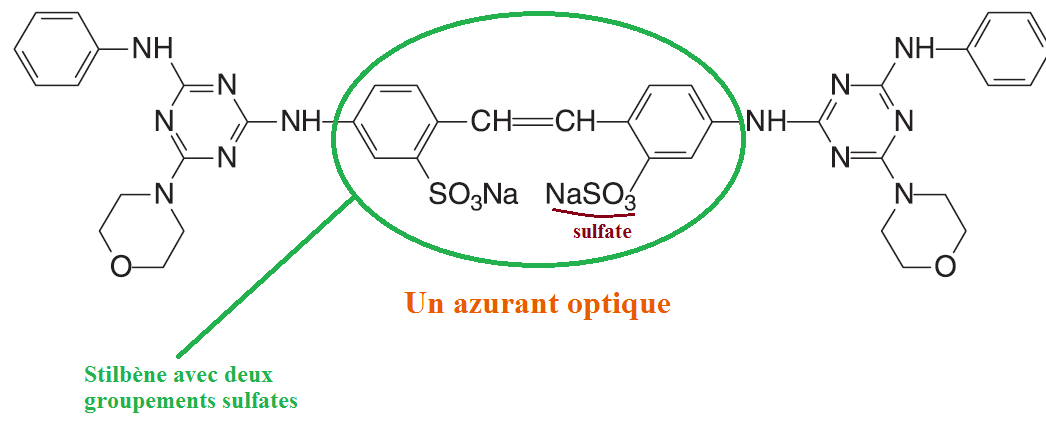
Les azurants sont souvent des dérivés de stilbène et possèdent des groupements sulfates. Ces groupements rendent la molécule polaire et donc lui assurent une bonne solubilité dans l'eau (ce qui est important car les azurants sont très utilisés dans les lessives).
De plus ces groupements sulfates vont permettre à l'azurant de se lier à la cellulose par des liaisons hydrogènes (encore et toujours). Les liaisons se font entre les oxygènes de l'azurant (groupement sulfate) et les hydrogènes des alcools de la cellulose.
L'azurant a cette capacité d'absorber la lumière dans l'ultra-violet (il est donc incolore). Cette absorption lui confère une importante énergie : la molécule est alors dans un état excité et va donc pouvoir libérer son surplus d'énergie sous forme de chaleur ou en émettant de la lumière : c'est la fluorescence !
Les azurants sont donc des molécules fluorescentes : elles peuvent donc émettre de la lumière et notamment de la lumière bleue (vers 400-500 nm), ainsi elles complètent la couleur manquante dans le spectre, que la cellulose avait absorbée.
Mais ce n'est pas tout, car en plus de renvoyer toutes les couleurs, l'azurant émet de la lumière : d'où ce blanc éclatant, que l'on qualifie souvent de "plus blanc que blanc".
Lessive avec des azurants optiques
En bonus voici le fameux sketch de Coluche où il se moque des lessives qui lavent "plus blanc que blanc" !
Bibliographie
- Wikipédia azurants optiques
- Wikipédia cellulose
- Articles de l'actualité chimique sur les lessives
Autres articles