Ice and salt challenge
(Photo : @gendarmerie nationale)
Un challenge est revenu à la mode sur les réseaux sociaux : le « ice and salt challenge ». Ce dernier consiste à s’appliquer du sel sur la peau puis de rajouter de la glace par-dessus. Très vite une sensation de brûlure se fait sentir, l’objectif du défi étant de tenir le plus longtemps possible.
Mais alors comment des ingrédients si communs peuvent-ils provoquer de si sévères brûlures ? Analysons le phénomène, chimie à l’appui !
Observations
Petite expérience made in les petits béchers ;)
Explications
Pour comprendre ce phénomène il faut tout d’abord s’intéresser à la structure de l’eau.
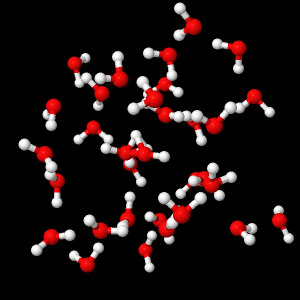
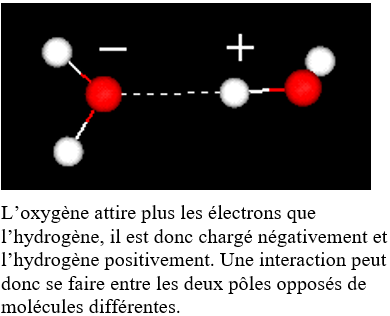
L’eau liquide est constituée d’un très grand nombre de molécules d’eau (De 5 à 6 moles d’eau pour un verre d’eau, donc environ 1024 molécules H2O) qui établissent des liens électrostatiques entre elles (appelés liaisons hydrogènes). Ces liaisons se font et se défont en permanence, et chaque molécule est assez libre de son mouvement.
Agencement des molécules d’eau en phase liquide
Liaison hydrogène entre deux molécules d'eau
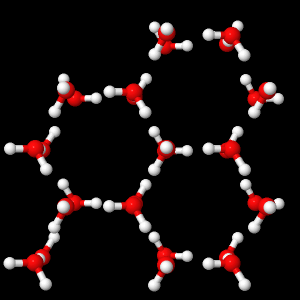
En phase solide l’agencement des molécules est beaucoup plus figé, les molécules d’eau restent proches d’une position d’équilibre. Elles forment des liaisons hydrogènes durables entre elles et la structure obtenue est symétrique.
Agencement des molécules d’eau en phase solide (glace)
L’eau passe de l’état liquide à solide à 0°C : c’est la solidification. L’action inverse, lorsque que l’on fait fondre la glace est la fusion.
Maintenant que se passe -t- il lorsque l’on met en contact du sel avec de la glace ?
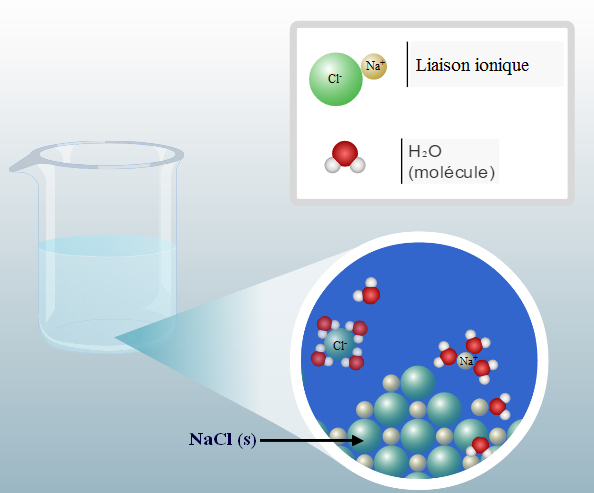
Le sel solide a lui aussi une structure bien organisée et très symétrique. Le sel est constitué d’ions sodium Na+ (en violet sur la figure) et d’ions chlorure Cl- (en vert sur la figure), et sa formule brute est NaCl (s).
Structure solide du sel : NaCl(s)
wikipédia
Les liaisons entre les ions Na+ et Cl- sont de nature ioniques (liaisons entre un cation et anion).
Pour la suite il est important de comprendre que casser une liaison chimique nécessite de l’énergie et construire une liaison fournit de l’énergie.
Pour bien comprendre cela on peut imaginer deux amoureux s'embrassant (#MétaphoreStValentin), essayez de les séparer : il va falloir y mettre du sien : donc de l’énergie. Inversement lorsque l’on va les rassembler, l’un va courir vers l’autre et le « choc » de leur rencontre va libérer de l’énergie.
Lorsque l’on dépose du sel sur un glaçon ce dernier possède une fine pellicule d’eau liquide à sa surface, le sel NaCl (s) va donc se dissoudre dans cette pellicule d’eau. Cette dissolution ne nécessite pas d’énergie et n’en fournit pas non plus : on dit que ce phénomène est athermique.
Dissolution et solvatation de NaCl par H2O
www.edumedia-sciences.com
Puis les ions solvatés vont entrer en contact avec la glace solide, ils vont alors désirer s’insérer entre les liaisons hydrogènes et arracher les molécules d’eau à la glace. Ce phénomène va augmenter la solvatation des cations et des anions.
Cependant ce processus casse des liaisons hydrogènes entre les molécules d’eau, et pour cela il faut de l’énergie (processus endothermique). Cette énergie va venir de la glace sous forme de chaleur. La glace va en effet fournir de la chaleur pour permettre la solvatation des ions.
Les conséquences de tout ceci sont la diminution de la température de la glace (perte de chaleur) et la fonte de cette dernière puisque l’on casse les liaisons hydrogènes qui permettaient la cohésion de la glace solide.
Et voilà tout le paradoxe : le processus diminue la température de la glace et la fait fondre en même temps !
La température de la glace peut ainsi descendre jusqu’à -21,6°C et provoquer d’importantes brûlures par le froid. Pour être plus précis on dit que l’eau forme un mélange eutectique avec le sel. C’est le mélange de deux corps purs qui fond et se solidifie à température constante.
Bibliographie
- https://fr.wikipedia.org/wiki/Chlorure_de_sodium
- https://fr.wikipedia.org/wiki/Eutectique
- http://phymain.unisciel.fr/du-sel-pour-refroidir/
Autres articles