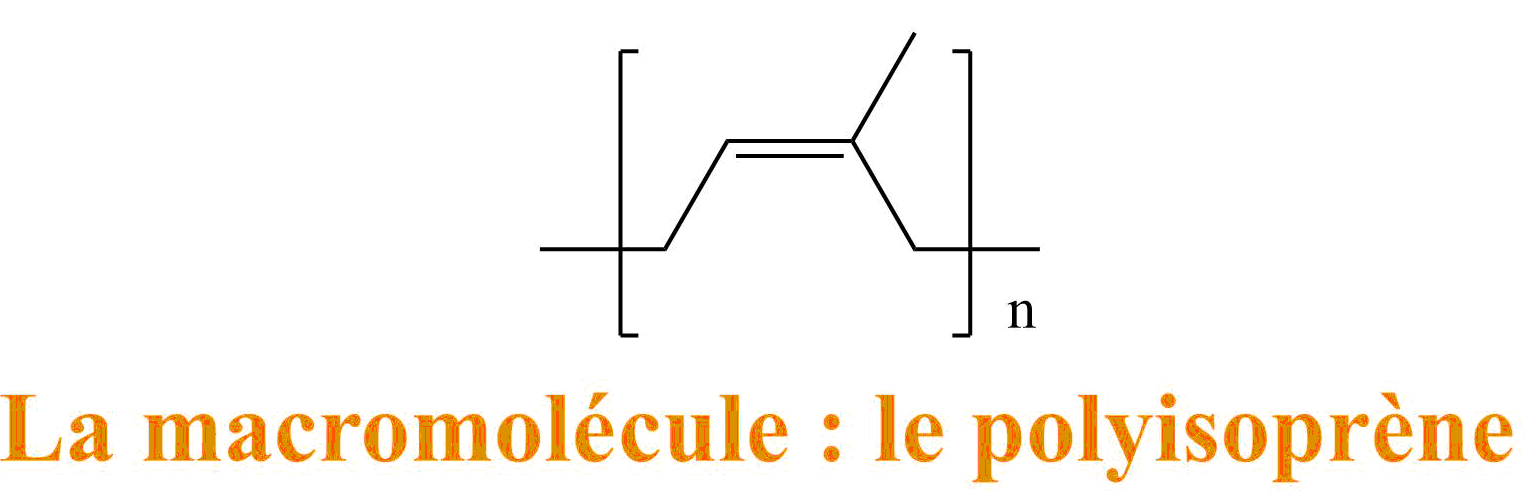Breaking Bad Chemistry (BBC) S1E1 partie 1
Un jour un grand homme a dit :
"Chemistry is, well technycally, chemistry is the study of matter. But I prefer to see it as the study of change." WW
(La chimie c'est, et bien techniquement, la chimie c'est l'étude de la matière. Mais je préfère l'envisager comme l'étude de ce qui change.)
# musique de tambours #
Résumons rapidement Breaking Bad en quelques mots : chimie, enquêtes policières, drames familiaux, cancer, trafiques d'argent, de drogues, crimes...tout ça tout ça ! Bref un joyeux mélange explosif.
Attention ceci est une alerte spoiler de niveau 4 ! Restez calme, ceci n'est pas un exercice ! Je répète alerte spoiler niveau 4 !
Etudions la chimie de l'épisode 1 de la saison 1.
Walter contribue à un prix Nobel
Dans la maison de Walter on peut voir dès l'épisode 1 l'affiche suivante :
Breaking bad, saison 1 épisode 1
Sur cette affiche, il est précisé que Walter a contribué au prix Nobel de Chimie de 1985. Ce prix Nobel a été décerné aux professeurs Herbert A. Hauptman et Jerome Karle pour leur "développement de méthodes directes de détermination des structures cristallines."
Précisons un peu tout cela :
Tout d'abord qu'est-ce qu'une structure cristalline ?
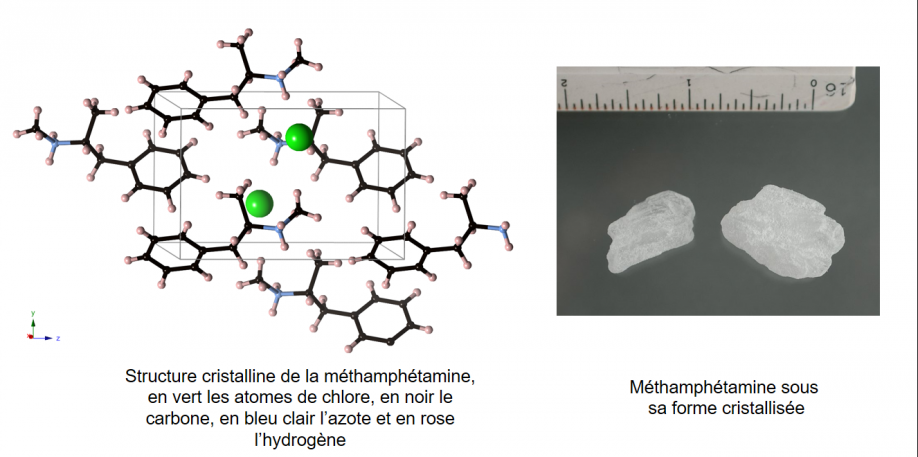
Dans structure cristalline on peut repérer le mot cristal (comme dans "crystal meth"). Un cristal c'est un solide dont les éléments (atomes, ions, molécules...) sont organisés selon un motif qui se répète un grand nombre de fois. Des cristaux bien connus sont : la neige, les pierres précieuses, le sucre, le sel, les métaux... et aussi la méthamphétamine sous sa forme pure, qui lui vaudra le surnom de "crystal meth".
La structure cristalline c'est donc tout simplement la manière dont sont organisés les éléments de notre cristal (atomes, ions, molécules...).
Structure cristalline du sel, de formule NaCl (s), agencement régulier et périodique d'ions Na+ et Cl- :
Ci-dessous la structure cristalline de la méthamphétamine, de formule C10H16NCl, cela n'est peut-être pas super visible mais les molécules sont organisées périodiquement dans l'espace. On en reparlera bientôt ;).
(Crédit crystallography365.wordpress.com
Quelle est l'importance de connaitre ces structures ?
En chimie bien connaitre les structures cristallines est primordial, cela revient à avoir une photo 3D précise de notre cristal. En biochimie par exemple il est important de connaitre l'agencement dans l'espace et la structure de grosses molécules comme des protéines ou des enzymes pour comprendre leur mode d'action.
Comment fait-on pour déterminer ces structures ?
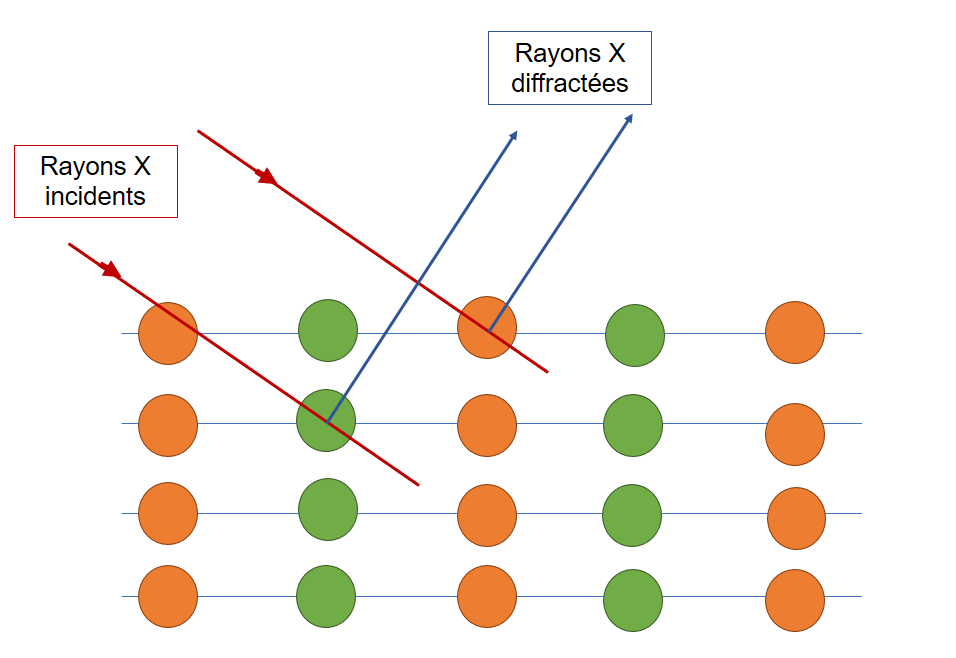
Pour obtenir des informations sur la structure d'un objet on utilise la lumière. En regardant comment cette lumière aura été modifiée après avoir interagit avec notre cristal on pourra en déduire la structure du cristal.
L'interaction lumière-matière qui nous intéresse ici c'est la diffraction. Notre cristal possède un agencement périodique d'atomes (par exemple), ainsi chaque atome va constituer "un obstacle" pour la lumière.
Chaque atome va donc diffracter la lumière dans certaines directions de l'espace et on obtient donc une figure d'interférence que l'on peut analyser. (Pour ceux qui connaissent cela fonctionne comme un réseau).
Schéma de fonctionnement de la diffraction des rayons X sur un cristal
Cependant pour pouvoir se diffracter (interagir) avec les atomes, la lumière doit avoir une longueur d'onde du même ordre de grandeur que nos atomes (environ 10-10 m). Dans le cas contraire notre lumière "évite" en quelque sorte l'obstacle.
A savoir : la longueur d'onde notée λ, c'est la distance que parcoure l'onde pendant sa période. Plus la longueur d'onde est faible, plus l'onde possède une énergie importante. (La fameuse formule E = hc/λ).
Pour que la longueur d'onde corresponde il faut donc utiliser des rayons X, qui possèdent une petite longueur d'onde (environ 10-10 m). Une petite longueur d'onde signifie grande énergie, il n'est donc pas prudent de s'exposer longtemps aux rayons X.
L'analyse des rayons diffractés va nous donner des informations sur la structure du cristal. Et l'information qui intéresse le plus les chimistes c'est la densité électronique du cristal.
La densité électronique c'est comment les électrons se répartissent au sein du cristal. On peut en déduire la position moyenne de nos atomes, leur nature, les types de liaisons entre ces atomes...c'est vraiment surpuissant comme information !
Cependant le chimiste fait alors face à un problème majeur en science physique : le problème de phase ! Et c'est là que le prix Nobel de 1985 intervient.
Le problème de phase
La phase d'une onde c'est en quelque sorte son retard par rapport à une autre onde, ou un autre groupe d'onde : on parle de différence de phase.
Ce retard entre les ondes est de l'ordre de grandeur de leur période. Pour les rayons X, la période est très petite et vaut environ T = 3*10-19 s.
Pour pouvoir observer un retard de cet ordre de grandeur (et donc mesurer la différence de phase), il faut que l'on ait un appareil qui prenne des photos toutes les 3*10-19 s. Il est impossible d'avoir un appareil avec une telle précision. Ainsi on ne peut mesurer la différence de phase des rayons X diffractés, l'information sur la phase est alors moyennée dans les images que l'on obtient.
Or sans la phase on ne peut obtenir la densité électronique du cristal et donc on ne peut déterminer précisément la position des atomes et leur agencement dans l'espace.
(La densité électronique s'obtient en faisant une transformée de Fourrier inverse de l'onde diffractée, sans phase on a accès à une quantité réelle et on ne peut donc pas faire de transformée de Fourrier)
La solution du chimiste : la fameuse méthode directe ! Prix Nobel de 1985.
La méthode directe
La méthode directe s'appelle ainsi car elle permet de déterminer la densité électronique directement des données collectées.
Son principe est simple : il faut déterminer les différences de phases des ondes diffractées. Pour cela deux hypothèses sont réalisées :
1. La densité électronique de notre cristal est toujours positive ou nulle en tout point du cristal.
Cette hypothèse est très valable, en effet la densité c'est le nombre d'électrons par unité de volume. Les électrons existent (densité positive) ou n'existe pas (densité nulle).
2. Il faut qu'un grand nombre de mesure de l'intensité soit réalisé.
En effet pour déterminer la différence de phase, Hauptman et Karle utilisent des équations dont la validité n'est que statistiquement probable. Avec un grand nombre de mesure devant le nombre d'équation on va statistiquement tendre vers des phases plus "justes".
Et Walter White dans tout ça ?
Sur l'affiche il est précisé que Walter a travaillé sur "the proton radiography", c'est à dire sur la radiographie des protons ;). Mais dis-moi Jamie c'est quoi une radiographie ?
Et bien c'est très simple :
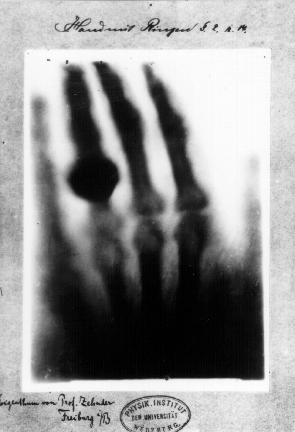
La radiographie classique fonctionne un peu comme des ombres chinoises, on envoie un faisceau de rayons X sur la zone du corps humain que l'on veut observer. Les différents organes traversés vont plus ou moins absorber les rayons X, et on récupère une image avec un détecteur à la sortie du corps humain.
Les organes ayant fortement absorbés les rayons X apparaîtront en noir sur la radio (les os), et ceux n'ayant pas absorbés (tissus mous) apparaîtront en blanc. On obtient en quelque sorte "une ombre chinoise" de nos os.
Première radiographie de l'histoire prise le 22 décembre 1895
Mais quid de la radiographie des protons ?
Les protons sont capables de pénétrer beaucoup plus dans la matière que la lumière et donc que les rayons x, on peut donc supposer obtenir des images d'objet qui absorbaient beaucoup trop les rayons X.
Cependant les premières radios obtenues avec cette méthode sont peu prometteuses : les images sont floues. Ce problème vient de la diffusion des protons lorsqu'ils se déplacent dans un objet, en raison de leur charge électrique.
De plus la radiographie des protons est encore peu employée aujourd'hui, produire un faisceau de proton coûte en effet relativement cher.
Il est difficile de voir comment Walter White aurait pu contribuer au prix Nobel de 1985, même si les deux champs d'études sont liés, l'objectif étant d'obtenir des images ou des informations sur la structure de la matière.
Si vous avez des idées sur la manières dont Walter aurait pu participer à ce prix Nobel, n'hésitez pas à le mettre dans les commentaires :)
Bibliographie
-
Le site officiel des prix Nobel : http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1985/press.html
-
http://culturesciencesphysique.ens-lyon.fr/ressource/imagerie-medicale-radiographie-principe.xml
-
http://culturesciencesphysique.ens-lyon.fr/ressource/Diffraction-rayons-X-techniques-determination-structure.xml
-
Wikipédia page "cristallisation"
-
Wikipédia page "Détremination d'une structure cristalline"
-
Wikipédia page "Phase problem"
Autres articles
Incroyable ! On dirait de la magie !
Tintin et le caoutchouc
Incroyable ! On dirait de la magie !
Harry Potter et la chambre des secrets
Bien le bonjour à tous :)
Nous voici en route pour une nouvelle année à Poudlard, avec son lot d'elfes de maison, de gâteau renversé sur la tête, de voiture volante, de saule cogneur et autre basilic : bref une scolarité tout à fait classique...Dumbledore président ! ;)
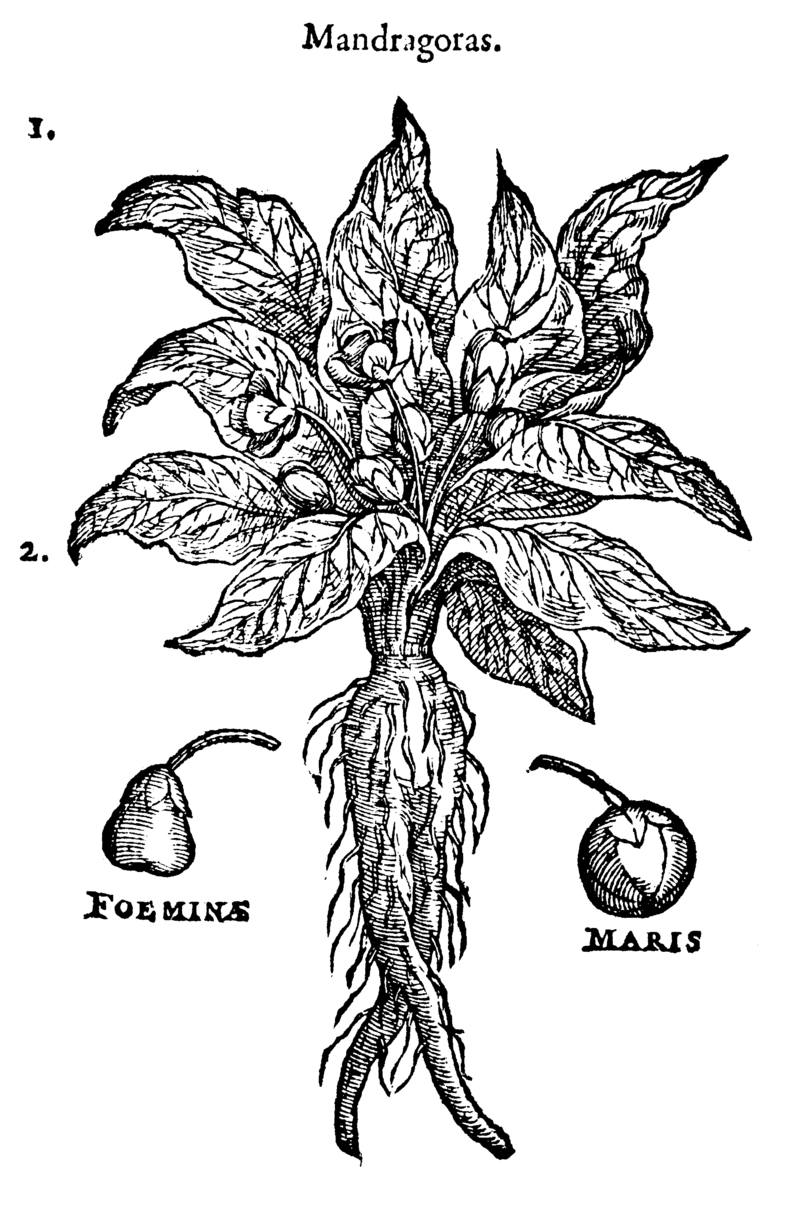
- Aujourd'hui nous allons rempoter des mandragores, qui peut me dire quelles sont les propriétés de la mandragore ?
- La mandragore, ou mandragora est utilisée pour ramener ceux qui ont été pétrifiés à leur état d'origine. Elle est aussi très dangereuse, le cri de la mandragore est mortel pour quiconque l'entend !
Merci miss Granger, mais quand est-il d'un point de vue chimique ? ;)
Les mandragores existent
La mandragore est une plante qui existe bel et bien, son nom botanique est Mandragora officinarum. Ces racines ont un aspect humanoïde qui est à l'origine de nombreux mythes, c'est d'ailleurs l'un d'entre eux qui est repris dans Harry Potter : elle émet un cri mortel lorsqu'on la déracine.
La mandragore :
wikipédia
Cette plante est constituée de nombreux alcaloïdes, ce sont des molécules organiques cyclique contenant un atome d'azote dans leur cycle. Elles sont très souvent d'origine naturelle et ont des propriétés pharmacologiques à faible dose.
La caféine, la morphine, la nicotine, et la strychnine sont des alcaloïdes (la terminaison en "ine" est caractéristique).
A forte dose certains alcaloïdes peuvent être mortels. Ainsi même si la mandragore a un effet anesthésique (supprime la sensibilité du système nerveux) qui aurait pu être exploitable, son utilisation fut très limitée par un nombre important d'effet secondaire (présence de trop d'alcaloïdes).
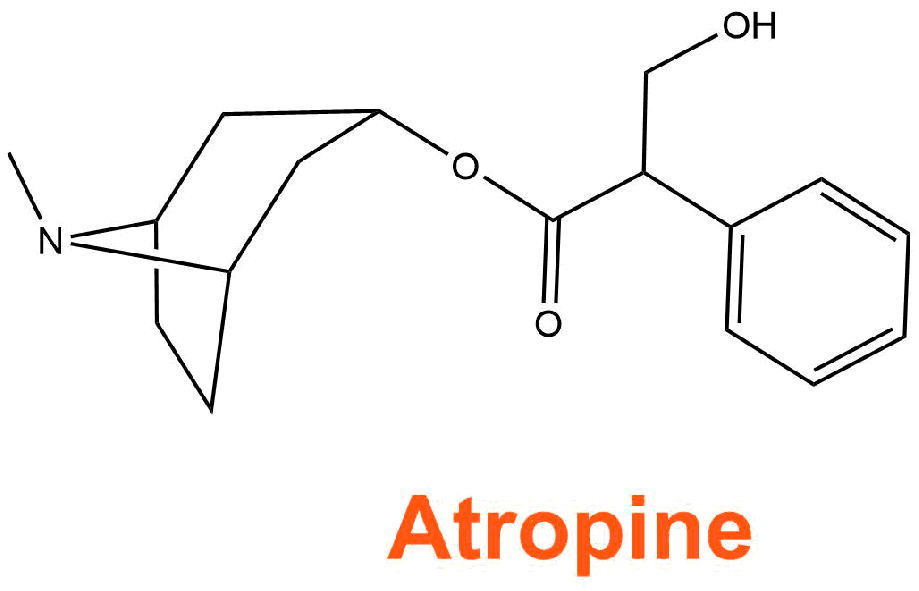
L'astuce du chimiste est alors d'isoler la molécule présente dans les racines de mandragores et responsable de l'effet thérapeutique. Ainsi c'est en 1885 que le chimiste français Crouzel réussi à isoler la mandragorine ou encore appelée l'atropine.
Pas si loin...;)
Dans Harry Potter la mandragore sert à ramener à la vie les personnes pétrifiées par le terrible basilic, nous allons voir que les effets de l'atropine n'en sont pas si loin ;)
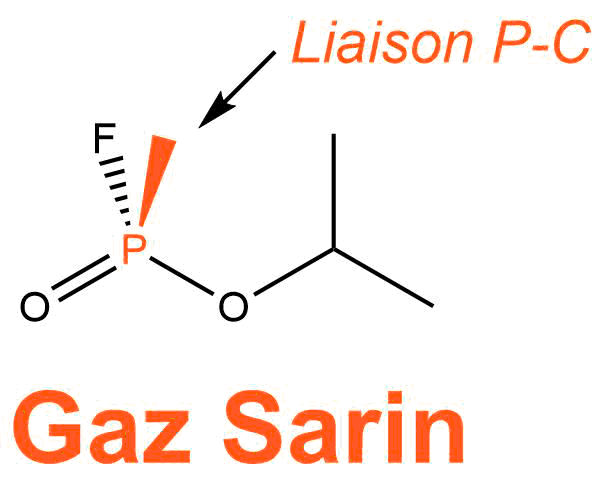
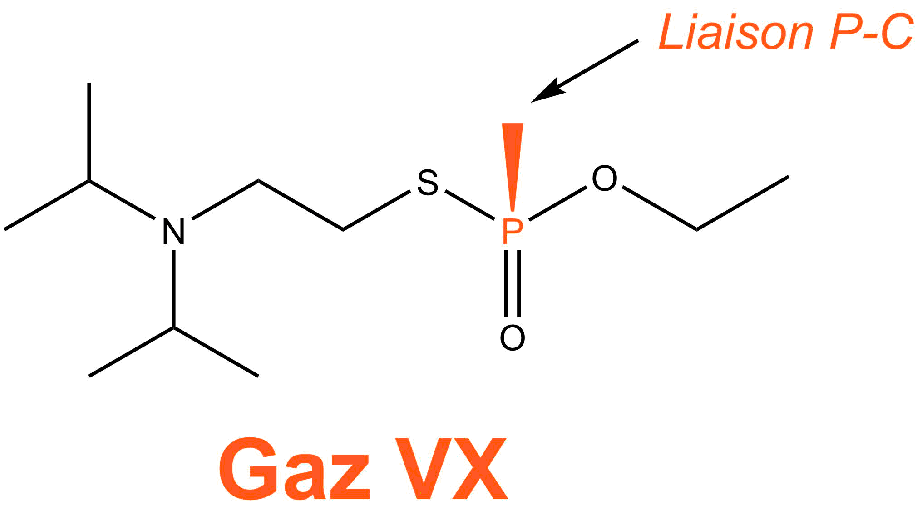
L'atropine est utilisée comme antidote des gaz de combat neurotoxiques comme par exemple le gaz VX ou le gaz sarin. Ces gaz ont la particularité d'être tous des composés organophosphorés : ils possèdent une liaison phosphore-carbone.
Ces gaz de combats sont hautement toxiques pour l'organisme car ils provoquent une stimulation trop importante des cellules nerveuses du système parasympathique : celui qui contrôle le fonctionnement autonome des organes, des glandes et des vaisseaux sanguins.
Cette sur-stimulation mène à la contraction des pupilles, une salivation importante, des urinations involontaires, des convulsions et à une mort par asphyxie causée par l'arrêt des muscles respiratoires.
Film the rock, 1996, Dr. Stanley Goodspeed joué par Nicolas cage, tentant de récupérer les capsules contenant le VX
Pour comprendre le rôle de l'atropine en tant qu'antidote, il faut tout d'abord étudier l'action des composés organophosphorés :
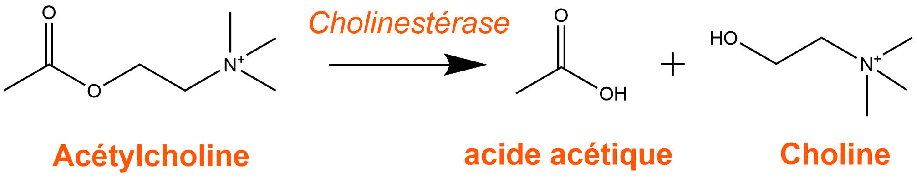
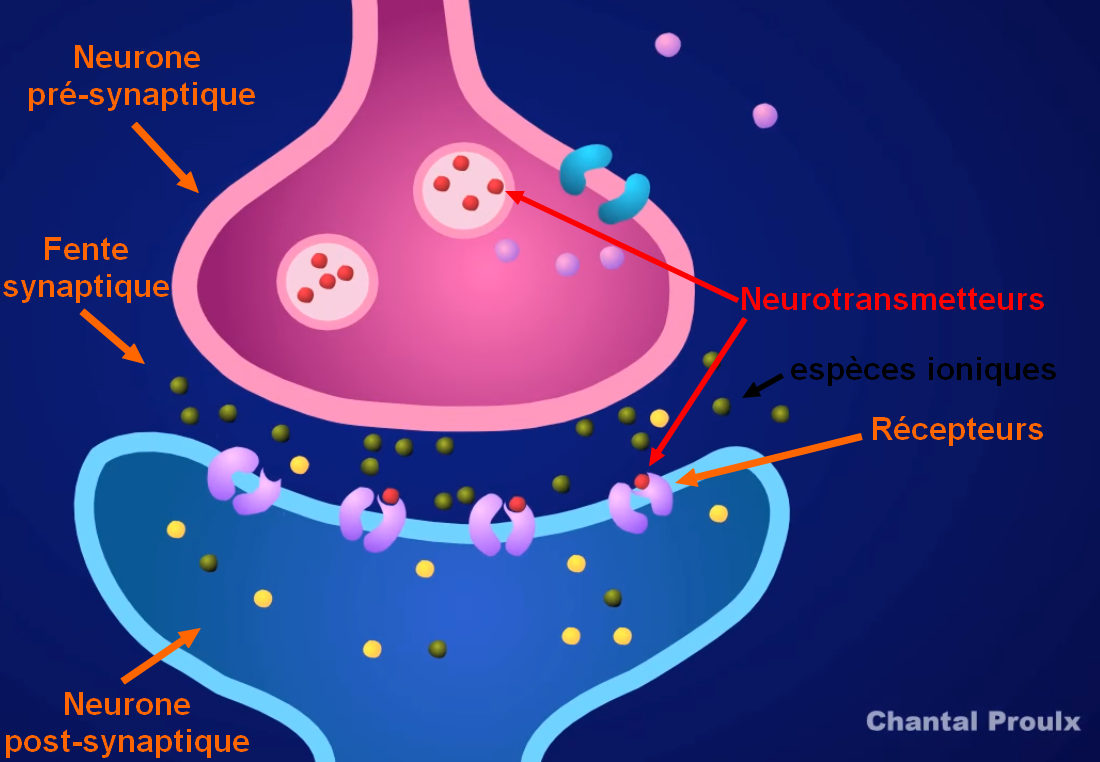
Ces gaz provoquent dans le corps humain une inhibition de la cholinestérase : une enzyme responsable de l'hydrolyse (la destruction) de l'acétylcholine en choline. C'est une réaction d'hydrolyse d'un ester (acétycholine) en un acide carboxilique (acide acétique) et un alcool (choline).
Or l'acétylcholine est un neurotransmetteur (messager chimique entre deux neurones), elle se fixe sur les récepteurs du neurone post-synaptique et provoque la propagation du message nerveux entre les neurones, pour conduire à terme à la contraction/activation des muscles.
La contraction est stoppée par la destruction du neurotransmetteur par la cholinestérase.
https://youtu.be/nM_v114rjwo, Chantal Proulx
Ainsi l'inhibition de la cholinestérase par les composés organophosphorés conduit à une présence permanente de l'acétylcholine sur le récepteur et donc à une contraction permanente des muscles, pouvant aller jusqu'à l'asphyxie.
L'atropine : l'arme ultime contre le basilic
L'atropine agit en se fixant sur les récepteurs post-synaptiques à la place de l'acétylcholine, ainsi l'abondance d'acétylcholine n'a aucun effet puisque ces dernières n'ont pas accès aux récepteurs.
De plus même si l'atropine est fixée aux récepteurs, elle est inerte et ne provoque pas d'influx nerveux : les muscles du système parasympathique se relâchent donc par absence de signal.
L'atropine permet donc d'éviter l'activation permanente des muscles du système parasympathique : ceux qui fonctionnent de façon autonome. Et donc d'empêcher une sorte de paralysie, mais qui ne concernerait pas les muscles du système somatique (les muscles que l'on fait fonctionner volontairement, notamment pour se mouvoir).
Prendre de l'atropine après un fougueux mais téméraire eye contact avec notre ami le basilic ne vous rendra donc pas vos mouvements, mais cela vous permettra de rester en vie, du moins temporairement ;)
Bibliographie
- World of chemistry : Essentials , fourth editionPar Melvin D. Joesten,John L. Hogg,Mary E. Castellion
- Wikipédia : pages mandragore, organophosphorés, atropine
- http://www.popularmechanics.com/science/health/a9388/how-it-works-atropine-the-nerve-gas-antidote-15859092/
Autres articles
Roger Rabbit et la trempette The one ring
Tintin et le caoutchouc
Tintin au Congo (Ed. Casterman 1946)
Bien le bonjour à tous :)
Dans la bande dessinée Tintin au Congo, notre cher ami Tintin redouble d'ingéniosité pour nuire aux animaux d'Afrique.
Afin de se venger d'un buffle l'ayant projeté dans l'eau, Tintin utilise les propriétés de l'hévéa pour construire un lance pierre géant et assommer le pauvre animal. Analysons ce passage chimie à l'appui ;)
Voici le passage étudié :
Le caoutchouc
Comme nous l'avions vu dans l'article sur : La chimie du ballon de basket, le caoutchouc est un polymère. C'est à dire qu'il est constitué de molécules de très grande taille (et de très grande masse molaire) : des macromolécules.
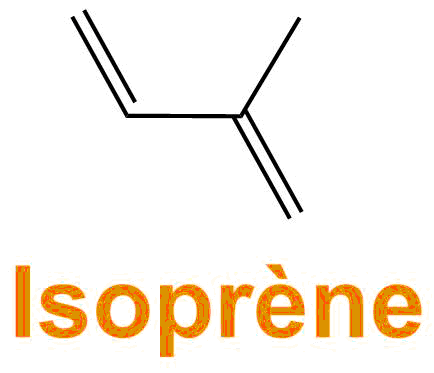
Ces macromolécules sont caractérisées par la répétition de petites molécules : on parle d'unité de répétition. Ces petites molécules s'obtiennent après réaction d'une molécule de départ avec elle-même, cette molécule de départ c'est le monomère.
Dans le cas du caoutchouc naturel :
- La "molécule de départ" = monomère est l'isoprène
- La macromolécule : est une répétition d'une petite molécule provenant de l'isoprène de départ (après qu'il ait réagit)
Le polymère caoutchouc est donc constitué d'un nombre important de ces macromolécules : longue chaîne que l'on peut assimiler à des spaghettis, le polymère correspond alors à l'ensemble du plat de spaghetti.
Dans Tintin
Tintin extrait le caoutchouc de "l'arbre à caoutchouc", aussi appelé hévéa. La sève de cet arbre : le latex, est un liquide laiteux constitué de 70 % d'eau et de 30 % de caoutchouc.
Comme le précise très bien Tintin, le latex sortant de l'arbre doit ensuite être séché pour faire partir l'eau et ne conserver que le caoutchouc. Cependant Tintin a oublié de nous faire part d'une étape cruciale, celle qui donne son élasticité au caoutchouc : la vulcanisation !
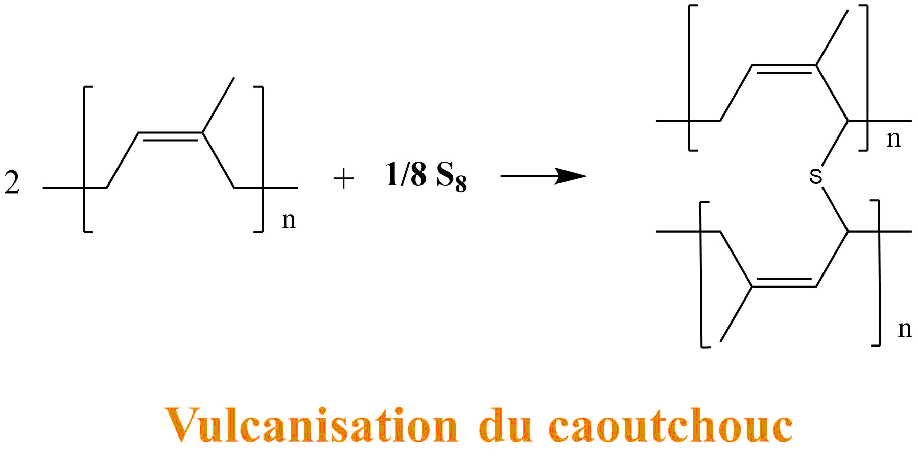
La vulcanisation est une réaction chimique qui consiste à relier chaque longue chaîne (formant une macromolécule) entre elles. Cela revient à relier tous les spaghettis entre eux.
Pour cela il faut ajouter un ingrédient indispensable : le soufre. Ce dernier va réagir avec les doubles liaisons présentes dans nos chaînes et former des ponts entre les chaînes.
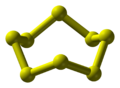
Le soufre, présenté dans la réaction ci-dessus, est sous sa forme solide la plus stable : appelé Sα ou encore S8.
Soufre S8, chaque boule correspond à un atome de soufre :
wikipédia
Les ponts ainsi formés agissent tels des ressorts sur notre polymère. Quand on l'étire le polymère se déforme puis, il revient dans son état initial lorsque la contrainte est stoppée.
La vulcanisation est une étape délicate, trop de soufre entre nos chaînes va rigidifier la structure et le composé ne sera plus élastique. De même trop peu de ponts va conduire à une faible élasticité.
Tintin ne peut donc pas utiliser directement le caoutchouc sortant de l'hévéa pour fabriquer son lance pierre.
Un grand merci à mon prof de Chimie de prépa qui nous a présenté le cours sur les polymères de manière ludique et attractive avec cet exemple :).
Bibliographie
- http://www.societechimiquedefrance.fr/caoutchouc.html
- https://fr.wikipedia.org/wiki/Vulcanisation
Autres articles